
کهکشان راه شیمی
نوشتن بیرون جهیدن از صف مردگان است.
کهکشان راه شیمی
نوشتن بیرون جهیدن از صف مردگان است.کنکور سراسری چند دفترچه؟! چند ساعت؟

کنکور سراسری تجربی :
دفترچه اول: زیست شناسی۴۵سوال = ۴۵ دقیقه
دفترچه دوم: فیزیک۳۰ سوال + شیمی۳۵ سوال =کل دفترچه ۷۵ دقیقه
دفترچه سوم: ریاضی۳۰ سوال + زمین۱۵ سوال =کل دفترچه ۶۰ دقیقه
کنکور سراسری انسانی :
دفترچه اول : ریاضی ۲۰ سوال + ادبیات ۳۰ سوال + اجتماعی ۱۵ سوال + روانشناسی ۱۵ سوال = کل دفترچه ۷۵ دقیقه
دفترچه دوم : عربی ۲۰ سوال + تاریخ ۱۳ سوال + جغرافیا ۱۲ سوال + فلسفه منطق ۲۰ سوال + اقتصاد ۱۵ سوال = کل دفترچه ۷۵ دقیقه
کنکور سراسری ریاضی :
دفترچه اول: ریاضی ۴۰ سوال = ۷۰ دقیقه
دفترچه دوم: فیزیک ۳۵ سوال + شیمی ۳۰ سوال = کل دفترچه ۷۵ دقیقه
فرآیند قلع اندود کردن ظروف مسی در کارگاهی در ترکیه و فصل دوم شیمی دوازدهم
قلعاندود کردن، فرآیندی است که در آن سطح فلزاتی مانند مس یا آهن با قلع پوشانده میشود. این پوشش قلع باعث میشود که فلز در برابر خوردگی و زنگ زدگی مقاومتر شود و عمر مفید آن افزایش یابد. به طور خاص، در مورد بشقابهای مسی که برای سرو کباب استفاده میشود، قلعاندود کردن کمک میکند تا سطح مس در برابر حرارت و مواد غذایی مقاومت بیشتری داشته باشد و از ایجاد واکنشهای شیمیایی ناخواسته جلوگیری کند. این فرآیند معمولاً با حرارت دادن قلع و پوشاندن آن روی سطح فلز انجام میشود. قلع (Tin) یک عنصر شیمیایی است که نماد آن "Sn"است. قلع فلزی نقرهای و براق است که بهطور طبیعی در سنگهای معدنی یافت میشود. از قلع معمولاً برای قلعاندود کردن سطوح فلزی (پوشاندن فلزات با لایهای از قلع) و همچنین در ساخت آلیاژها (مانند برنز) استفاده میشود.
سوسک اسیدی بی تربیت
سوسکهای بمب انداز میتوانند اسیدی با دمای ۱۰۰ درجه به سمت دشمنانشان اسپری کنند!
محاسبه آنتالپی واکنش به کمک قانون هس دقیق تره یا به کمک انتالپی های پیوند؟
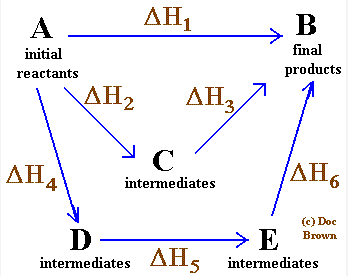
۱●دقت بالاتر دادههای ترمودینامیکی: قانون هس بر اساس دادههای ترمودینامیکی دقیق مانند آنتالپی تشکیل ترکیبات شیمیایی عمل میکند. این دادهها معمولاً از آزمایشهای دقیق و استاندارد به دست میآیند و خطای کمتری دارند. در مقابل، آنتالپی_پیوند میانگینی از انرژی پیوند در ترکیبات مختلف است و ممکن است تحت تأثیر ساختار مولکولی و محیط شیمیایی قرار گیرد، بنابراین دقت کمتری دارد.
۲● استقلال از ساختار مولکولی: - قانون هس مستقل از ساختار مولکولی است و فقط به حالت اولیه و نهایی واکنش توجه میکند. این باعث میشود محاسبات بدون در نظر گرفتن پیچیدگیهای ساختاری انجام شود. - آنتالپی پیوند به ساختار مولکولی وابسته است و ممکن است در ترکیبات مختلف متفاوت باشد، که این موضوع محاسبات را پیچیدهتر و کمتر دقیق میکند.
۳●قابلیت استفاده برای واکنشهای پیچیده: - قانون هس برای واکنشهای پیچیدهتر که شامل چندین مرحله هستند، قابل استفاده است و میتوان آنتالپی کل واکنش را با جمع جبری آنتالپی مراحل مختلف محاسبه کرد. - محاسبه آنتالپی پیوند برای واکنشهای پیچیده دشوارتر است، زیرا نیاز به در نظر گرفتن تمام پیوندهای شکسته و تشکیلشده دارد و ممکن است خطاهای بیشتری ایجاد کند.
۴● عدم نیاز به اطلاعات پیوندی: - قانون هس نیازی به اطلاعات دقیق درباره انرژی پیوندهای خاص ندارد و فقط به آنتالپی تشکیل ترکیبات شیمیایی وابسته است. - در روش آنتالپی پیوند، نیاز به دانستن انرژی تمام پیوندهای درگیر در واکنش است که ممکن است همیشه در دسترس نباشد یا دقیق نباشد.
۵● تأیید تجربی بیشتر: - قانون هس بر اساس اصول ترمودینامیکی است که به طور گسترده در آزمایشها تأیید شدهاند. این قانون به طور مستقیم از قانون اول ترمودینامیک (پایستگی انرژی) نتیجه میشود. - آنتالپی پیوند بیشتر بر اساس میانگینگیریهای تجربی است و ممکن است در شرایط مختلف نتایج متفاوتی ارائه دهد.



_9469.gif)


